

前言
您将获得:
时间地点
培训时间:2023年6月13日-7月31日(49天)
开班时间:2023年6月12日 20:00
培训地点:药视网培训考试系统
培训内容
包含14次视频课程+2次实战经验分享+4次考试+4次直播答疑+每日资料分享
课程内容:
一、CSV基础知识课程:数据可靠性在计算机化系统的合规要求
1、《CSV&DI基础知识 -数据可靠性在计算机化系统的合规要求》
2、GAMP 5 章节1 Introduction
3、GAMP5 章节2 Key Concept
1、《CSV&DI基础知识 -系统配置与变更管理 Configuration Management》
2、GAMP 5 Appendix M8:Project Change and Configuration Management (验证阶段)
3、GAMP 5 Appendix D3:Configuration and Design (设计阶段)
4、GAMP 5 Appendix 06:Operational Change and Configuration Management(运维阶段)
1、《CSV&DI基础知识 -审计追踪功能与回顾 Audit Trail function and Review》
2、GAMP 5 Appendix D7 3.3.5:Audit Trail
3、大侠针对审计追踪总结
1、《CSV&DI基础知识 -用户权限与安全设置 Access Control and Security》
2、GAMP5-Section 15 Security。
3、NIST美国国际信息标准与技术协会– 什么是用户管理
1、《CSV&DI基础知识 -备份还原与归档 Backup、Restore & Archiving》
2、大侠讲解没有测试环境,生产设备的备份还原怎么做
3、GAMP 5 Appendix O9 & O13– Backup& Restore ; Archiving & Retrieval
1、《CSV&DI基础知识 -计算机化系统数据可靠性风险评估与管理》
2、GAMP 5 第五章– Quality Risk Assessment
3、《基于风险的的数据完整性管理实践指南》
4、《ISPE 记录与数据指南 – 数据可靠性概念及数据生命周期管理》
1、《CSV&DI基础知识 -业务连续性与灾难恢复 + 数据迁移vs数据传输》
2、GAMP 5 Appendix D7– Data Migration
3、GAMP 5 AppendixO10– Business Continuity Management
4、NIST ——如何做好业务连续性指南
WMS+WCS 项目CSV验证模拟实践
1、GxP影响性评估 – WMS仓库管理系统及WCS仓库自动化控制系统
2、GxP BP业务流程梳理 – WMS+WCS上线后可能影响的GxP业务流程
3、CSV QRM - 基于业务风险和数据完整性的计算机化系统验证策略
4、其他话题自由交流
八、CSV基础知识课程总结:中国GMP 计算机化系统与欧盟GMP附录11 计算机化系统
1、《法规的学习与利用 -中国GMP 计算机化系统与欧盟GMP附录11 计算机化系统》
2、2015版– 中国GMP计算机化系统
3、2011版欧盟附录11 计算机化系统
4、2020版中国药品记录与数据管理要求(试行)
九、CSV进阶实战经验:如何判断一个系统是否需要CSV验证
1、概念梳理
1.1、纵向思考 从GMP质量管理-》验证-》计算机化系统验证
1.2、横向类比 仪器验证,设备验证,计算机化系统验证及工艺验证
2、案例讲解
2.1、切入点1 – 药品全生命周期的电子记录和数据可靠性合规
2.2、切入点2 – 复杂计算机化系统基于风险的验证方法
2.3、切入点3 – 适用于IT流程服务运维的GxP计算机化系统
十、CSV进阶实战经验:CSV项目中运用确认与验证策略的相同与不同
1、背景介绍
1.1、英文语义下Verification,Qualification及Validation三者的相似点与不同点
1.2、CSV项目中运用Verification,Qualification及Validation不同策略的具体举例
2、案例讲解
2.1、Policy原则 – 如何关联公司Validation 主体SOP和CSV 验证SOP的相互关系
2.2、Standard标准 – 在药企CSV验证Validation中,3Q确认Qualification测试如何按照标准有效执行
2.3、Case Study 案例 – 实际计算机化系统验证案例中,Validation与qualification是如何相辅相成,交叉运用的
十一、CSV进阶实战经验:如何区分电子数据vs电子记录,如何从GMP签名理解电子签名
1、What法规介绍
1.1、法规简介
1.2、法规起草历史
2、How 应用指南
2.1、法规内容分析
2.2 、合规应用实施方法
3、Case Study 案例分析
十二、CSV进阶实战经验:CSV监管要求变严格情况下,遗留系统如何满足合规要求前提下,进行补充验证和管理?
1、What法规介绍
1.1、CSV&DI法规逐渐变严的趋势
1.2、警告信和483案例分析
2、How 应用指南
2.1、短期合规措施 – 遗留系统验证与管理现况差距分析及临时控制措施
2.2、长期解决方案 – Data Governance数据治理理念及Computerized System Compliance 计算机化系统合规体系
3、Case Study 案例分析
十三、CSV进阶实战经验:GAMP 5 2022版内容中,对于IT infrastructure qualification 的要求解读与应用实践
1、What指南介绍
1.1、GAMP 5 2.0 新版内容中,对于IT infrastructure qualification的内容解读
1.2、行业良好实践介绍:ITIL 及 ISO27000
2、How 应用指南
2.1、IT技术趋势 – 超融合技术、高可用冗余服务器及备份一体机
2.2、CSV解决方案 – 备份与还原,时间管理,业务连续性与灾难恢复
3、Case Study 案例分析
十四、 CSV进阶实战经验总结:欧美兴起的“From CSV to CSA”反应了业界的哪些变化趋势
1、What背景介绍
1.1、文章简介
1.2、质量管理思路对比“正确的做事VS做正确的事”
2、How 应用指南
2.1、CSV方法的困局
2.2、 CSA方法的优势
3、Case Study 案例分析
期末实战经验分享课程:
新建疫苗智能工厂项目模拟演练
1、IT基础建设 – GxP机房,服务器虚拟化,工业环网
2、GxP 信息化架构 – MES,LIMS,WMS,QMS,TMS,DMS及ERP、BMS、EMS架构及先后关系分析
3、CSV 策略- 如何基于业务风险和数据完整性的计算机化系统验证保障智能工厂项目实施
4、其他话题自由交流
更多详细学习内容欢迎扫描下方二维码咨询

讲师介绍
胡大伟,国际制药项目管理协会(IPPM)特聘讲师,药视网特聘讲师,曾在香港供职于甲方药企GSK、Fortune及澳美制药,也曾供职乙方IT咨询公司,2019年回到深圳信立泰工作;曾参与ERP,MES,WMS,CDS,PIC/S迎检,欧盟迎检,FDA OCT迎检等项目,有着丰富的计算机化系统验证与数据可靠性合规经验。
培训模式
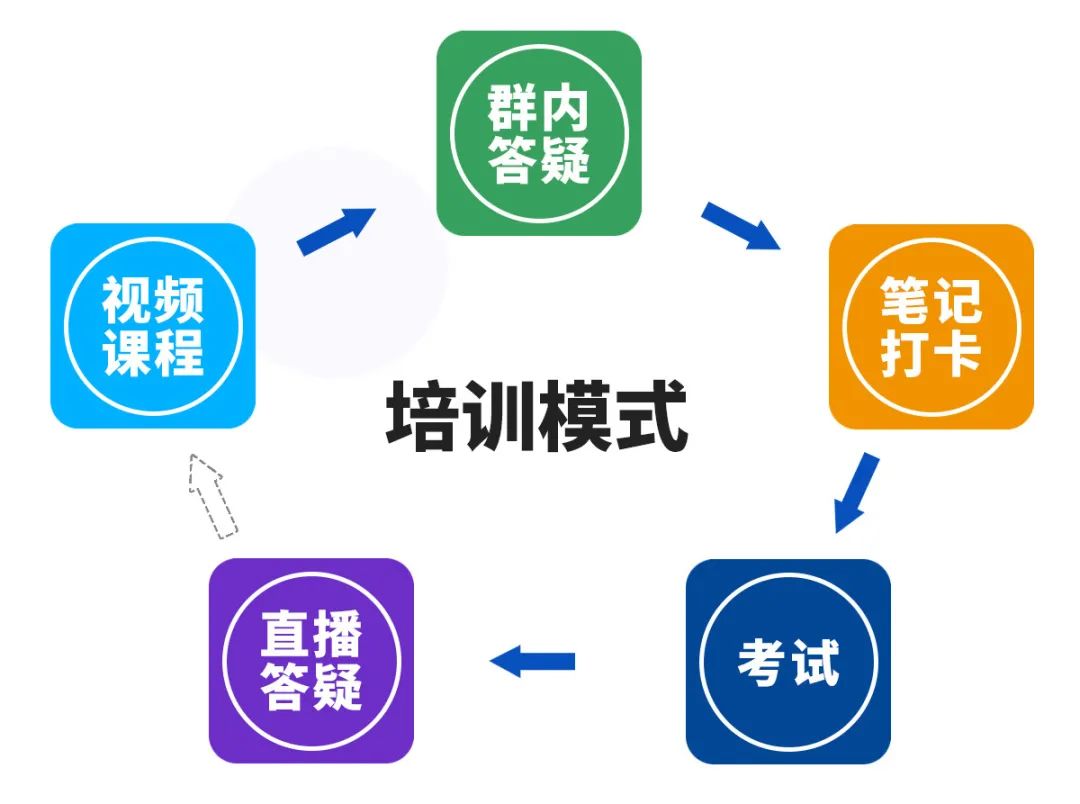
特别提醒:不是每天都是老师讲课,但是有问题随时可以问,间隔直播答疑。
组织机构
主办单位:
药视网
承办单位:
徐州易云企业服务有限公司
支持单位:
药搭文档管理系统
苏州豚鼠科技有限公司
支持媒体:
蒲公英、药林网、药聘网
培训对象:
1、 GMP工厂:QA、QC、生产、公共工程部门业务骨干、技术人员;
2、药企总部集团:质量负责人、IT信息化规划负责人、生产自动化负责人、研发与实验室数字化负责人及新建项目项目经理等。
费用与福利
报名咨询
扫描识别下方二维码进行报名咨询

报名及VIP咨询
| 文件名 | 上传时间 | 大小 |
|---|