

如何将自检真正的变成企业质量体系持续改进的工具?如何实现对委托生产企业进行有效监控是每个MAH必须关注的重点?自检人员、供应商审计人员、和日常的GMP符合性检查人员,如何按要求完成企业内部的自检和审查工作?审查的重点如何有效把控?专职人员如何制定和实施内部的审查和审计?相信很多企业并不能完全的理解和执行到位。
为帮助企业掌握GMP自检/内审手段,提升识别药品质量风险和法规符合性缺陷的能力,强化企业整体质量体系和质量保证水平,全面落实企业对药品全生命周期和全过程主体责任的原则,药视网特别联合多位具有丰富一线工作经验的讲师带你一起学习如何灵活有效的开展自检工作以及自检对于企业质量管理的价值,欢迎广大药友报名参加。
您将获得:
时 间 地 点
Time and place
培训时间:2023年3月2日-2023年4月5日(35天)
培 训 内 容
Training content
主要内容:
一、MAH制度下的持有人审计管理
1、MAH制度下的持有人的审计主体责任
2、MAH制度下审计的合规要求
3、MAH制度下,持有人如何审计CMO工厂
4、MAH制度下,持有人如何审计原辅料供应商
5、MAH制度下,持有人如何进行自检
二、自检与审计的要素和流程
1、自检/内审的类型与管理流程梳理
2、年度自检计划
3、自检/内审团队与人员
4、自检/内审工作的执行及注意事项
5、自检/审计记录和报告
6、自检/内审工作的常见问题及改善方案
7、常规自检案例分析
三、质量管理保证系统审计要点
1、质量保证系统的合规要求
2、质量管理文件系统审计
3、组织机构与人员,培训管理
4、基于风险的验证管理及验证审计
5、用户投诉、退货及召回审计
6、质量保证系统审计常见缺陷及案例分析
7、委托生产质量管理制度流程审计
四、物料系统自检和审计的重点和常见问题分析
1、供应商资质确认
2、物料验收(验收、取样、放行或拒收、定期复验)
3、仓储控制(库存管理、物料发放、温湿度控制等)
4、物料的不合格品及退货管理
5、物料管理系统常见缺陷分析
五、QC系统自检现场检查的审计重点基缺陷分析
1、QC系统自检现场检查流程
2、QC系统“人”因素审计重点及缺陷分析
3、QC系统“机”因素审计重点及缺陷分析
4、QC系统“料”因素审计重点及缺陷分析
5、QC系统“法”因素审计重点及缺陷分析
6、QC系统“环”因素审计重点及缺陷分析
六、生产工艺系统自检和审计重点及注意事项
1、共线生产风险评估及生产管理模式
2、生产过程中数据真实性及可追溯性
3、生产文件可操作性及执行一致性
4、关键工艺参数、关键质量属性评估及输出过程
5、物料等级评定原则及转移过程
6、工艺转移技术转移过程、工艺参数演变过程
7、环境监测位置确认过程、检测数据统计分析
8、工艺验证或持续工艺确认管理
9、人员培训及人员操作规范性
七、设施和设备系统自检和检查重点和要求
1、整体厂房硬件的管理要求
2、公用工程系统的检查要求
3、洁净区现场硬件的检查要求
4、设备系统总体检查要求
5、设备的维护与保养
6、仪器仪表的校验要求
7、厂房设施和设备中常见问题分析
八、数据可靠性专项自检和审计要点
1、全球数据可靠性法规进展及趋势分析
2、PIC/S对计算机化系统的特殊数据完整性考量
3、实验室系统和生产系统的数据完整性要求
4、数据完整性的审计重点及实验室容易出现的问题
共计:约32学时(按50分钟/学时计)
培 训 模 式
Training mode
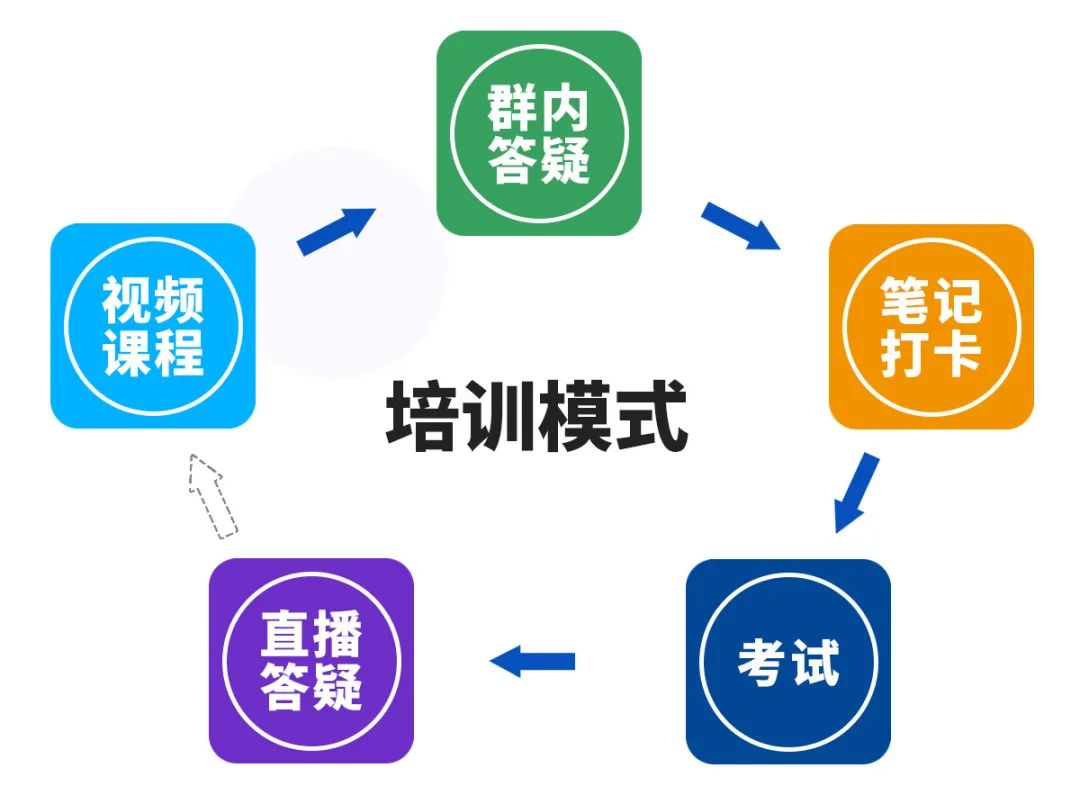
包含约32学时课程+6次答疑+5位讲师+每日群内互动
特别提醒:不是每天都是老师讲课,但是有问题随时可以问,间隔直播答疑。
讲 师 介 绍
Introduction of lecturer
叶非 药视网特聘讲师、ISPE会员,从事无菌制剂、非无菌制剂质量管理20年,欧美认证13年。全面参与原料药、无菌原料药、冻干粉针、小容量注射剂、口服制剂的中国、FDA及欧盟GMP认证工作。对于原料药、无菌原料药及无菌制剂的GMP要求及技术有深入的研究。精通无菌工艺、实验室要求、产品验证、制药用水等。
朱老师 药视网特聘讲师,先后在扬子江药业、济川药业、苏州润泽制药从事药品质量管理、药品研发注册等工作近三十年,多年担任公司质量负责人;熟悉中药、化学药各类剂型的技术管理要求,具有丰富的药品生产质量体系建设和运行管理经验,多次领导公司通过GMP认证、注册核查等各类检查。
李秀娟 二十多年制药企业生产、质量、采购、物流、仓储工作经验,有国企、外企、私企工作经历,现就职于大型集团药品生产企业。熟悉欧盟和中国GMP、GSP政策法规,熟悉药品GMP和GSP现场检查及认证,熟练原料药、固体制剂、生物制品等产品工艺技术要点和质量控制过程,熟悉物料管理及采购管理,熟悉智能化仓库硬件、软件、信息化规划设计。
焦红江 蒲公英联合创始人,瑞特威设计咨询管理(深圳)有限公司创始人;近30年制药企业生产/设备/工程/项目管理经验,近10年制药工程概念设计/设计辅导/图纸审核/GEP/GMP咨询经验,做过数百个医药项目车间的图纸审核、厂房设计咨询辅导(包含十多家细胞基因疫苗类生物制药企业);曾参与数十家企业内训、模拟审计、咨询顾问、多家生物医药产业园区规划咨询与设计辅导工作;熟悉各种制药装备、生产工艺与生产过程控制,熟悉项目用地规划、政府报建流程、概念设计、工程设计、招标投标、设备选型、施工过程GEP管理、成本质量进度控制、确认验证、项目总包管理、交钥匙服务、园区规划、招商辅导、产业化落地服务。
费 用&福 利
Cost & benefit
1、培训原价:1999元/人(含授课费/证书费/发票)
2月20日前:1599元/人(报2再送1)
2月20日起:1999元/人(报2再送1) 2、药视网VIP会员于优惠价(1599元)基础上享受5折(799元)参与本次学习营 户名:徐州易云企业服务有限公司 开户行:中国工商银行徐州市淮海东路支行 账号:1106020409210313389 (付款请注明“自检训练营”)
报 名 咨 询
Registration consulting
扫描识别下方二维码进行报名咨询

报名及VIP咨询
组 织 单 位
Organizational units
主办单位:药视网 承办单位:徐州易云企业服务有限公司 支持单位:药搭文档管理系统苏州豚鼠科技有限公司 支持媒体:蒲公英、药仪网、药聘网 培训对象: 1、制药企业质量管理部门负责人、质检负责人、审计负责人等; 2、制药企业相关的生产、QA、QC、物管、设施设备、验证等相关人员。
| 文件名 | 上传时间 | 大小 |
|---|