

时 间 地 点
Time and place
培训时间:2023年1月17日-2023年3月10日(53天)
培训地点:线上培训
组 织 单 位
Organizational units
主办单位:药视网
承办单位:徐州易云企业服务有限公司
支持单位:药搭文档管理系统苏州豚鼠科技有限公司
支持媒体:蒲公英、药林网、药聘网
培训对象:
1、从事药品研发、生产与注册的制药企业、研发公司、科研院所等相关工作人员;
2、从事研发质量管理、生产操作、生产管理及研发分析等岗位人员;
4、从事药品注册申报、研发项目管理等岗位人员;
5、从事药事法规教育及药品研究机构的相关工作人员;
培 训 内 容
Training content
一、药物研发质量管理的背景
1、目前制药行业的研发质量管理现状与预警
2、研发质量管理的意义和重要性
1、广义和狭义上对研发质量管理体系的理解
2、药物研发阶段的细致分类以及每一阶段的特点
3、MAH体制下,申请人与GLP、GCP、CDMO之间的关系和管理
4、研发质量管理的主要内容
1、研发质量体系建立的法规依据;
2、研发期间组织机构与人员管理
3、研发期间文件体系建立时的考虑点
4、研发期间不同阶段厂房/设施、仪器/设备的管理要求
5、研发期间不同阶段生产、检验用物料及其供应商的管理要求;
6、研发不同阶段对偏差和变更的管理要求;
7、研发期间不同阶段对委托研究的管理要求;
8、项目的研发流程管理
9、研发阶段样品的管理
10、研发阶段的日常监控方式与监控内容
11、研发阶段数据与记录的管理要求
12、研发阶段技术转移的管理要求
13、临床样品管理程序
14、研发期间,CMC与GLP、GCP试验之间的衔接和逻辑关系
15、药物研发稳定性试验管理
16、药品生命周期中的清洁要求
1、研发质量管理过程中程度的把控
2、研发QA在体系建立和运行中的重要作用
3、研发分析与QC共用实验室的内部控制与挑战
4、整个体系下,研发/生产基地与非临床、临床部门之间的沟通、衔接
5、在未知因素、可变因素如此多的研发阶段,如何保证数据可靠性?
1、新注册形势下核查关注点的变化
2、注册核查要点与判定原则关键点介绍
3、各省局发布的注册现场核查清单
4、从注册现场核查要点分析药监对研发质量管理提出的要求
5、查验中心的基本核查思路以及历次核查发现的数据可靠性问题列举
1、研发质量体系与知识管理的融合
2、研发质量体系在药品注册申报过程中的作用
3、项目管理在药物研发过程中的思考
4、研发质量管理与新版GVP的综合考量
七、GMP附录临床试验用药品
1、附录修订的背景和执行落地思路和策略
2、条款关键点的解读
3、常见问题的解读
1、药品研发工艺验证及技术转移
2、药品研发清洁验证
3、实验室仪器验证(上)
4、实验室仪器验证(下)
5、分析方法验证概述及实施
6、分析方法转移及确认
1、细胞治疗产品质量控制研究
2、原材料和辅料及其质量控制
3、可提供T细胞的供体资质标准的建立
4、细胞治疗产品的生产工艺、质量控制研究及检测
培 训 模 式
Training mode
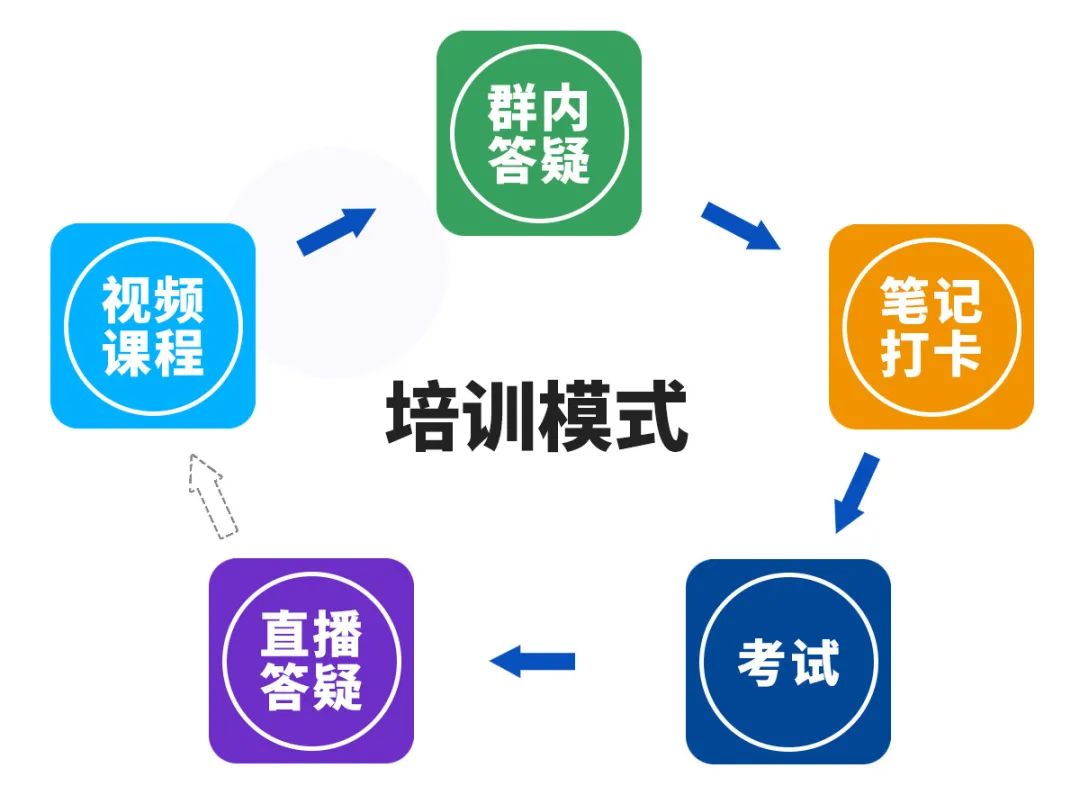
包含约48学时课程+12次直播课+8次答疑课+6位讲师+每日群内互动
特别提醒:不是每天都是老师讲课,但是有问题随时可以问,间隔直播答疑。
讲 师 介 绍
Introduction of lecturer
朱老师
先后在国内知名药企从事药品质量管理,药品研发注册工作24年,长期担任公司质量负责人;熟悉中药、化学药各类剂型的技术管理要求,多次领导公司通过GMP认证检查、药品注册检查,具有丰富的药品质量管理、实验室管理经验。
单老师
从事制药行业近二十年,职业经历涵盖药品和保健食品的生产、研发质量管理、及质量管理等各大职能区块。十年外资企业质量工作经验,曾担任国内大型企业质量保证负责人、以及国内知名制药公司的质量负责人和质量受权人;有注射剂(大容量注射剂)、化药固体制剂、中药制剂、原料药、细胞药物等剂型领域的质量管理经验。先后从事药品研发、注册和质量管理工作。质量管理工作主要对变更、偏差、质量风险管理、质量回顾等质量工作以及统计学工具在制药行业中的实际应用,有着丰富的实践经验,擅长解决实际问题,有丰富的质量体系的建立、完善管理的工作经验。
王老师
主管药师,先后从事中药、生化、细胞及化学药物相关工作16年,现就职于国内某家大型制药企业,主要负责公司的质量管理和技术转移工作。
张老师
毕业于武汉大学药学院,在新药研发一线工作十余年,目前担任某知名药企技术总监,主要负责新药的生产工艺开发和质量研究,先后管理并参与多个生物制品新药工艺开发、制剂研究和质量管理工作,并申报获得多个生物制品新药批件,产品顺利进入临床和上市阶段,在生物制品方面有丰富的工艺开发、生产和质量管理经验。
占老师
南昌大学药学院,从事药品研发分析工作十余年,具有丰富的分析方法开发与验证工作经验,在业内知名公众号发表具有广泛影响力的分析专业方面的文章近百篇,好评如潮。
贾老师
8年新药研发质量检验工作经验,7年化药厂、疫苗厂质量控制(QC)工作经验,现为某疫苗生产企业QA,主要负责QC的变更、偏差、OOS、OOT等质量事件的处理及其CAPA工作。
费 用&福 利
Cost & benefit
1、培训原价:1999元/人(含授课费/证书费/发票)
2023年1月10日前:1599元/人(报2再送1)
2023年1月10日起:1999元/人(报2再送1)
2、药视网VIP会员于优惠价(1599元)基础上享受5折(799元)参与本次学习营
3、汇款方式:
同步支持对公转账、支付宝及微信支付
户名:徐州易云企业服务有限公司
开户行:中国工商银行徐州市淮海东路支行
账号:1106020409210313389
(付款请注明“研发第四期”)
报 名 咨 询
Registration consulting
扫描识别下方二维码进行报名咨询

报名及VIP咨询
| 文件名 | 上传时间 | 大小 |
|---|